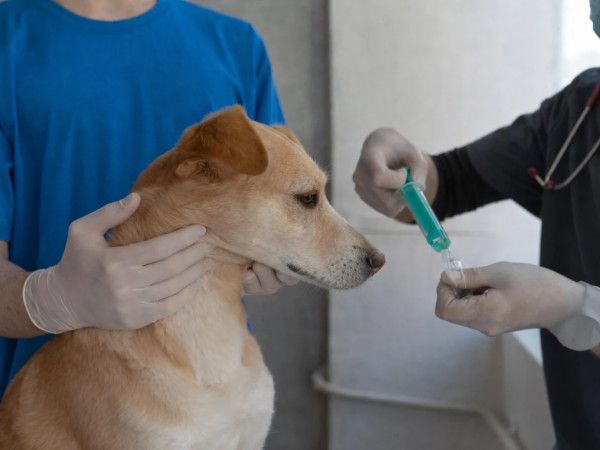
“ბოლო პერიოდში 50 წარმოების ლიცენზია იყო გაცემული. GMP რეგულაციების შემდეგ ოთხმა წარმოებამ გაიარა სერტიფიცირება და მიიღო GMP-ის სერტიფიკატი. ამჟამად მოქმედი გვაქვს ოთხი ფარმაცევტული წარმოება. დანარჩენი წარმოებების ნაწილი დაიხურა, ნაწილმა შეიცვალა სპეციფიკა და გადაერთო სხვა მიმართულებით, იგივე საკვები დანამატების, ბიოლოგიურად აქტიური ნივთიერებების წარმოებაზე, რაც ფრიად სამწუხაროა, რადგან შესაძლებელი იყო, რეფორმაზე გადავსულიყავით ნაკლებად ხისტი მეთოდებით, რაც მოგვცემდა იმის საშუალებას, რომ მეტი ადგილობრივი წარმოება ყოფილიყო GMP-ით სერტიფიცირებული…”- ამის შესახებ საქართველოს ფარმაცევტთა ასოციაციის თავმჯდომარე ლევან გოგიბერიძემ “საქმის კურსთან” ინტერვიუში განაცხადა.
როგორც ცნობილია, GMP &GDP სერტიფიკატის ფლობის ვალდებულება ფარმაცევტულ და სადისტრიბუციო კომპანიებს 2023 წლიდან აქვთ, რა დროიდანაც შესაბამისი სტანდარტის გარეშე ადგილობრივ ბაზარზე პროდუქციის განთავსება და რეალიზაცია მათთვის აიკრძალა. 2025 წლის 1 იანვრამდე რეგულაცია მხოლოდ იმ კომპანიებზე არ ვრცელდებოდა, რომლებიც ფარმაცევტული პროდუქტების ექსპორტს ახორციელებდნენ. მიმდინარე წლის 1 იანვრიდან კი რეგულაცია თანაბრად გავრცელდა ყველა ფარმაცევტულ თუ სადისტრიბუციო კომპანიაზე.
დარგობრივი ასოციაციის ხელმძღვანელი ამბობს, რომ GMP &GDP რეფორმაზე გადასვლა ნაკლებად ხისტი მიდგომებით იყო შესაძლებელი, რადგან რეგულაციის გავლენით ბევრი ფარმაცევტული საწარმო დაიხურა.
რეფორმა მიმდინარე წლის 1 ოქტომბრიდან გაფართოვდა და ევროპული GMP-ის გარეშე წამლის სუბსტანციის იმპორტიც აიკრძალა. ნებისმიერ სამკურნალო საშუალებას, რომელიც საქართველოში რეგისტრირდება ან ხელახალ რეგისტრაციას გადის, 1 ოქტომბრიდან ევროპული GMP სტანდარტის შესაბამისობის დამადასტურებელი დოკუმენტი უნდა გააჩნდეს როგორც საბოლოო პროდუქტზე, ასევე იმ სუბსტანციებზე, რომელიც მის დასამზადებლად გამოიყენება. აღნიშნული მოთხოვნის დაკმაყოფილება სავალდებულოდ შესასრულებელი გახდა როგორც დისტრიბუტორებისთვის, ისე ადგილობრივი მწარმოებლებისთვის.
“ამ ბოლო 477-ე დადგენილებით, რომელიც ძალაში შევიდა 1 ოქტომბერს, იქ არის ერთი ასეთი ჩანაწერი, რომ რომ არ შეიქმნას წამლის დეფიციტი სამინისტროს აქვს უფლება განაცხადის საფუძველზე, რომელსაც მას წარუდგენს კომპანია, ერთჯერადად დააკმაყოფილოს მოთხოვნა ამა თუ იმ მედიკამენტის შემოტანაზე, მიუხედავად იმისა გააჩნია GMP-ის შესაბამისობის სერთიფიკატი, თუ არა.
ვფიქრობ, ეს ფრიად საეჭვო საკითხია, რომელიც კითხვის ნიშნებს ბადებს, გამომდინარე იქიდან, რომ ჩვენ როდესაც აპელირებას ვაკეთებთ, რომ მედიკამენტი უნდა იყოს ხარისხიანი და ვიღებთ ასეთ კანონმდებლობას და ვითხოვთ GMP-ის სტანდარტს საბოლოო პროდუქტზეც, საწყის პროდუქტზე, ამ დროს რატომ ხდება ისე, რომ შესაძლებელია ვინმესთვის გამონაკლისი დაიშვას გონივრული ვადით, რომელიც არ ვიცით რას ნიშნავს და რამდენს ნიშნავს, თუმცა ამას შეიძლება მეორე კუთხიდანაც შევხედოთ, რომ ეს რაღაც ბუფერულ დროს შექმნის იმისთვის, რომ დეფიციტი არ გაჩნდეს და ამ პერიოდში გადავეწყოთ სხვა ბაზრებზე, თუმცა კითხვის ნიშნები არსებობს”-აცახდებს ლევან გოგიბერიძე.